| 行业类别 | 格式 | 大小 |
|---|---|---|
| 人教版高中化学必修一 | pptx | 6 MB |
描述
《原子结构与元素的性质》原子结构与元素周期表PPT
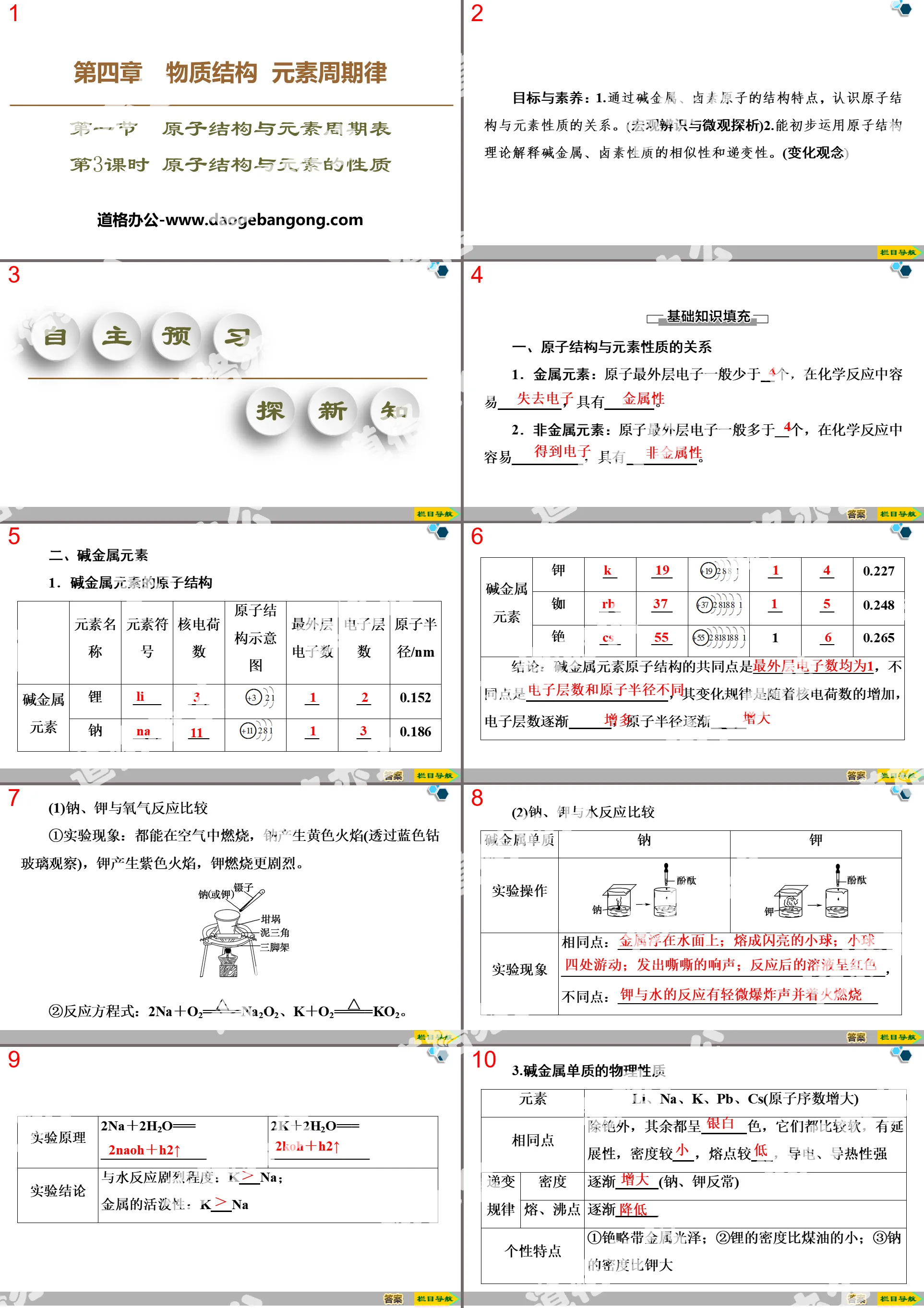
第一部分内容:目标与素养:
1.通过碱金属、卤素原子的结构特点,认识原子结构与元素性质的关系。(宏观辨识与微观探析)
2.能初步运用原子结构理论解释碱金属、卤素性质的相似性和递变性。(变化观念)
... ... ...
原子结构与元素的性质PPT,第二部分内容:自主预习探新知
一、原子结构与元素性质的关系
1.金属元素:原子最外层电子一般少于 个,在化学反应中容易________,具有________。
2.非金属元素:原子最外层电子一般多于 个,在化学反应中容易________,具有________。
二、碱金属元素
1.碱金属元素的原子结构
结论:碱金属元素原子结构的共同点是_________________,不同点是___________,其变化规律是随着核电荷数的增加,电子层数逐渐___________,原子半径逐渐___________
(1)钠、钾与氧气反应比较
①实验现象:都能在空气中燃烧,钠产生黄色火焰(透过蓝色钴玻璃观察),钾产生紫色火焰,钾燃烧更剧烈。
②反应方程式:2Na+O2=====△Na2O2、K+O2=====△KO2。
三、卤族元素
1.卤素单质的物理性质
2.卤素的原子结构特点
相同点
①卤族元素位于周期表第_____族;
②最外层上都有_____个电子。
递变性
从F→I核电荷数依次增大,电子层数依次_____,原子半径依次_____
3.卤素单质的化学性质
(1)卤素单质与氢气的反应
(2)卤素单质之间的置换反应
1.判断正误(正确的打“√”,错误的打“×”)
(1)碱金属元素即 ⅠA元素()
(2)K比Na活泼,故K可以从钠盐溶液中置换出Na()
(3)卤素单质与水反应均可用X2+H2O===HXO+HX表示()
(4)HX都极易溶于水,它们的热稳定性随核电荷数增加而增强()
2.下列金属与水反应最剧烈的是()
A.LiB.KC.RbD.Cs
D [在碱金属中,随着元素原子电子层数的增多,碱金属的金属活动性增强,四个选项中与水反应最剧烈的应是Cs。]
... ... ...
原子结构与元素的性质PPT,第三部分内容:核心突破攻重难
碱金属元素性质的相似性和递变性
1.相似性(R表示碱金属元素)
原子都容易失去最外层的一个电子,化学性质活泼,它们的单质都具有较强的还原性,它们都能与氧气等非金属单质及水反应。碱金属与水反应的通式为2R+2H2O===2ROH+H2↑。
2.递变性
随着原子序数的递增,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,碱金属元素的原子失电子能力逐渐增强,金属性逐渐增强。
(2)与O2的反应越来越剧烈,产物更加复杂,如Li与O2反应只能生成Li2O,Na与O2反应还可以生成 Na2O2,而K与O2反应能够生成KO2等。
(3)与H2O的反应越来越剧烈,如K与H2O反应可能会发生轻微爆炸,Rb与Cs遇水发生剧烈爆炸。
(4)最高价氧化物对应水化物的碱性逐渐增强,CsOH的碱性最强。
【典例】下列各组比较不正确的是()
A.锂与水反应不如钠与水反应剧烈
B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠
C.熔、沸点:Li>Na>K
D.碱性:LiOH<NaOH<KOH
B [A中锂的活泼性比钠弱,与水反应不如钠剧烈;B中还原性,K>Na>Li,但K不能置换出NaCl溶液中的Na,而是先与H2O反应;C中碱金属元素从Li到Cs,熔、沸点逐渐降低,即Li>Na>K>Rb>Cs;D中从Li到Cs,碱金属元素的金属性逐渐增强,对应最高价氧化物的水化物的碱性依次增强,即碱性:LiOH<NaOH<KOH<RbOH<CsOH。]
(1)碱金属单质的化学性质为什么具有相似性?
[提示] 结构决定性质,碱金属元素的原子结构相似,最外层均有一个电子,均易失电子,化学性质活泼,故他们的单质具有较强的还原性,能与氧气等非金属及水、酸反应。
(2)碱金属单质的化学性质为什么具有递变性?
[提示] 碱金属原子结构存在递变性。从Li到Cs,随核电荷数的增加,电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减弱,元素金属性逐渐增强;故单质的还原性逐渐增强,离子的氧化性逐渐减弱。
... ... ...
原子结构与元素的性质PPT,第四部分内容:当堂达标提素养
1.我国西部地区蕴藏着丰富的锂资源,开发锂的用途是一个重要的科学课题。关于锂的叙述不正确的是()
A.锂是较轻的金属
B.LiOH的碱性比NaOH弱
C.锂的金属性比钠强
D.锂在空气中燃烧生成Li2O
C [锂比钠的活泼性弱,在空气中燃烧只生成Li2O,LiOH的碱性比NaOH弱,锂的金属性比钠弱,C项错误。]
2.按氟、氯、溴、碘顺序,下列说法不正确的是()
A.它们的单质的熔、沸点逐渐升高
B.原子半径逐渐增大,单质氧化性逐渐增强
C.单质的颜色逐渐加深
D.它们气态氢化物的稳定性逐渐减弱
B [氟、氯、溴、碘的单质的熔、沸点逐渐升高,A正确;氟、氯、溴、碘同为第ⅦA族元素,同主族从上到下,原子半径逐渐增大,非金属性逐渐减弱,因此单质氧化性逐渐减弱,B错误;氟、氯、溴、碘的单质的颜色逐渐加深,C正确;非金属性F>Cl>Br>I,非金属性越强,氢化物越稳定,则它们气态氢化物的稳定性逐渐减弱,D正确。]
3.下列有关碱金属元素的叙述正确的是()
A.碱金属单质均为银白色,密度均小于水
B.碱金属单质从Li到Cs,熔点依次升高
C.氢氧化铯碱性强于氢氧化钠
D.碱金属元素形成的阳离子,从Li+到Cs+氧化性依次增强
C [碱金属单质中除了Rb、Cs,其他的密度均小于水,Cs略带金属光泽,其他的都是银白色的,A错误;碱金属单质从Li到Cs,熔点依次降低,还原性依次增强,形成的阳离子的氧化性依次降低,对应的氢氧化物碱性依次增强,C正确,B、D错误。]
... ... ...
关键词:人教版高中化学必修一PPT课件免费下载,原子结构与元素的性质PPT下载,原子结构与元素周期表PPT下载,.PPT格式;
更多关于《 原子结构与元素周期表原子结构与元素的性质 》PPT课件, 请点击 原子结构与元素周期表PPT原子结构与元素的性质PPT标签。
《原子结构与元素周期表》物质结构元素周期律PPT(第2课时原子结构与元素的性质):
《原子结构与元素周期表》物质结构元素周期律PPT(第2课时原子结构与元素的性质) 第一部分内容:学习目标 课程标准 1.认识碱金属元素、卤族元素的性质与其在元素周期表中位置的关系。 ..
《原子结构与元素的性质》原子结构与元素周期表PPT下载:
《原子结构与元素的性质》原子结构与元素周期表PPT下载 第一部分内容:素养目标 1.通过教材表格中的原子结构、原子半径信息知道碱金属元素、卤族元素的原子结构及特点。 2.通过教材提..
《原子结构与元素的性质》原子结构与元素周期表PPT课件:
《原子结构与元素的性质》原子结构与元素周期表PPT课件 第一部分内容:必备知识素养奠基 一、元素的性质 1.金属性 金属元素的原子最外层电子一般少于4个在化学反应中容易_________具..
文件信息
更新时间: 2024-11-21
所属频道:人教版高中化学必修一
素材版本:PowerPoint2003及以上版本(.ppt)
文件大小:1995 KB
显示比例:普屏4:3
附件类型:.rar
本模板属于 化学课件 人教版高中化学必修一 行业PPT模板
《原子结构与元素的性质》原子结构与元素周期表PPT简约校园招聘活动策划方案总结企事业单位招聘宣传演讲会PPT模板是由文稿PPT提供的商务岗位竞聘通用PPT模板,简约校园招聘活动策划方案总结企事业单位招聘宣传演讲会PPT模板,下载源文件即可自行编辑修改源文件里的文字和图片,如果想要更多精美商务PPT模板,可以来道格办公。道格办公PPT,海量PPT模板幻灯片素材下载,我们只做精品的PPT模板!
Tips:如果打开模版觉得不合适您全部需求的话,可以检索相关内容「《原子结构与元素的性质》原子结构与元素周期表PPT」即可。
Windows系统模版使用方法
直接解压文件后使用office 或者 wps即可使用
Mac系统模版使用方法
直接解压文件后使用office 或者 wps即可使用
相关阅读
更详细的PPT相关的教程、字体的教程可以查看: 点击查看
注意事项
不要在微信、知乎、QQ、内置浏览器下载、请用手机浏览器下载! 如果您是手机用户,请移步电脑端下载!
1、文稿PPT,仅供学习参考,请在下载后24小时删除。
2、如果资源涉及你的合法权益,第一时间删除。
3、联系方式:service@daogebangong.com
《原子结构与元素的性质》原子结构与元素周期表PPT由于使用限制,仅供个人学习与参考使用,如需商业使用请到相关官网授权。
(个人非商业用途是指以个人为单位、非商业产品运作的方式,运用该字体完成个人作品的展示,包括但不限于个人论文、简历等作品的设计)
预览效果